Верховная Рада поддержала во втором чтении законопроект № 4074 “О внесении изменений в статью 9 Закона Украины “О лекарственных средствах” (относительно доступа к результатам доклинического изучения и клинических испытаний лекарственных средств)”.
Об этом сообщает пресс-служба ВР.
За документ проголосовали 247 депутатов.
Законом дополнена часть одиннадцатая статьи 9 Закона Украины “О лекарственных средствах” словами “а также обеспечивать на своем официальном сайте свободный доступ ко всем результатам доклинического изучения и клинических испытаний лекарственных средств (отчетов о доклинических исследованиях и отчетов о клинических испытаниях, составленных по форме, установленной центральным органом исполнительной власти, обеспечивающим формирование государственной политики в сфере здравоохранения), которые являются открытой информацией”.
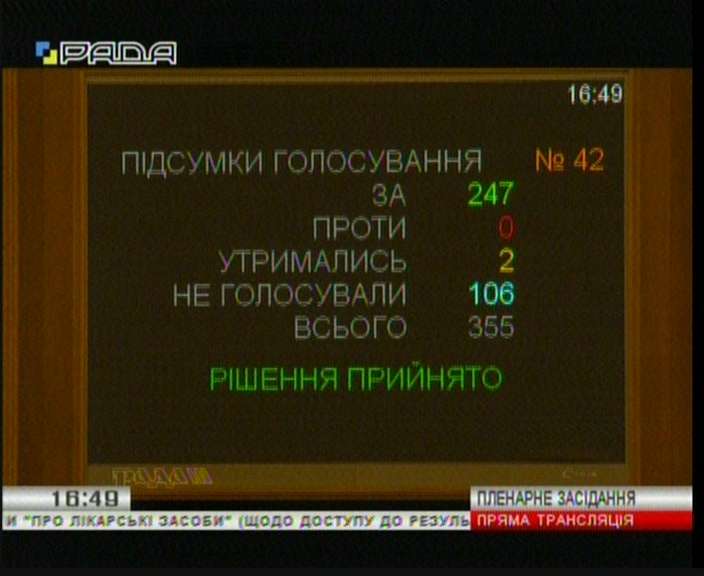
Фото: Пресс-служба ВР
Законом предусматривается, что центральный орган исполнительной власти, который реализует государственную политику в сфере здравоохранения, обеспечивает публичный доступ ко всем, как к благоприятно / положительным, так и неблагоприятным /отрицательным результатам доклинического изучения и клинических испытаний.
“Целью принятия законопроекта является открытие доступа к результатам доклинического изучения и клинических испытаний лекарственных средств, за исключением информации коммерческого конфиденциального характера, которая охраняется законом, что, в свою очередь, будет способствовать большей прозрачности, борьбе с коррупцией в данной сфере и обеспечению достоверности данных об эффективности и безопасности лекарственных средств”, – отмечается в пояснительной записке к проекту закона.
Ранее Правительство Украины поддержало проект постановления о внесении изменений в порядок государственной регистрации (перерегистрации) лекарственных средств.
Президент Украины Петр Порошенко подписал Закон “О внесении изменений в статью 9 Закона Украины “О лекарственных средствах”, который упрощает государственную регистрацию лекарственных средств.
В Минздраве уже приступили к обработке нормативных документов для упрощения регистрации лекарств из Евросоюза и США.





